编者按:抗肿瘤的策略正在不断发展当中,靶向治疗经历了最初的兴奋之后遇到了较大的阻力,包括原发性耐药和获得性耐药。通过联合用药以解决耐药的策略已经取得一些进展,虽然目前仍面临相当大的挑战,Nature Reviews Clinical Oncology杂志近期发表一篇综述对早期试验中联合靶向药物所面临的最主要问题以及将来应对的策略进行了详细解析。
随着我们对癌细胞、微环境和它们与宿主免疫系统相互作用的了解加深,导致了肿瘤治疗发展模式出现了转变。在过去的20年间,新药物的开发一直集中在已知的原癌驱动基因。其中一个经典例子是,BCR-ABL1驱动的慢性粒细胞性白血病(CML)患者给予伊马替尼出现较高的细胞基因反应率和长期缓解。伊马替尼被视为“一种药物靶向一种基因异常”药物发展模式的典范,但在现实中,该药物的疗效仅在CML中是例外,这反映了支配绝大多数癌症的生物复杂性。近年来,靶向抗癌药物逐渐增加,尽管在临床前实验中可以观察到初始高缓解率,然而大部分靶向药物(如PI3K、AKT、MET和IGFR抑制剂)单药使用并没有持续改善肿瘤患者的生存。伊马替尼在慢性粒细胞白血病的早期成功导致人们对于分子靶向治疗产生了过于美好但不切实际的期望,不过现实让人们逐渐清醒,这甚至已经导致了某些靶向药物,如 IGF/ IGFR抑制剂开发的过早终止,因为他们单用并没有表现出抗肿瘤活性。
确定对分子靶向药物高度敏感的肿瘤亚型,(“篮子”试验)已经产生了一些获益。此方案产生部分是因为原发性耐药是治疗失败生物一个重要原因,并且在某些情况下已经成功地通过联合治疗的方法克服,无论是与化疗(例如,利妥昔单抗与化疗联合治疗弥漫性大B细胞淋巴瘤)或与其它靶向治疗(如依维莫司和来曲唑治疗激素受体阳性乳腺癌)联合。此外,大量最初治疗有效的药物在选择压力下会导致肿瘤细胞克隆进化和增殖(获得性耐药)的机制已经被发现。一些获得性耐药的机制主要是该使药物对于靶点失效,例如,EGFR敏感突变发生T790M突变,这导致第一代EGFR抑制剂,如厄洛替尼和吉非替尼出现耐药。与此相反,其他耐药机制并不降低药物的疗效,而是激活代偿信号通路导致肿瘤出现耐药性,例如BRAF抑制剂治疗BRAF驱动的黑色素瘤可导致MEK信号通路的激活。在后一种模式中,联合使用靶向药物能规避补偿途径得激活从而防止获得性耐药的发展。事实证明,BRAF和MEK抑制剂联合使用导致BRAF突变黑色素瘤患者总体生存率改善。
因此,了解原发性和获得性耐药机制对于解释分子靶向抗癌药物联合疗法临床前疗效是必须的。在制定联合治疗的临床研究中,主要有以下几种联合策略:第一、联合致死,指药物单用在非选择性患者疗效甚微,而在具有基因组缺陷的特定患者中或与靶向补偿途径治疗联用时表现明显抗肿瘤活性。第二、协同作用,指联合方案中一种或所有药物都有临床疗效,但所观察到的临床活性比每种药物疗效的总和更强。第三、相加,即对肿瘤的影响等于这两种药物疗效的总和。最后,微弱拮抗,即作用发生时观察到药物组合的活性小于每一种药物疗效的总和,但超过组合中的每一种个体药物(图1)。大部分靶向药物在临床的联合模式都属于相加和微弱拮抗,然而,现在的研究都集中在明确联合致死或协同药物组合。
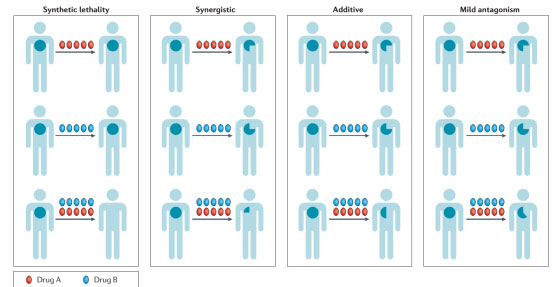
图1 肿瘤药物的联合模式
本文讨论的是靶向抗癌药物与其他靶向抗癌药物的联合,但不包括化疗。研究人员在设计和实施这些药物联合中面临复杂的挑战。本文旨在阐明这些挑战,并提出规避它们的策略,最终的目标是改善癌症患者的预后。
靶向药物联合面临的挑战
靶向治疗药物联合用于肿瘤治疗在发展中面临两个主要的挑战:第一是找到最好的药物联合。有些假设联合研究已经取得了一些成功,例如,临床中在KRAS突变的肿瘤中同时靶向MEK和Akt信号。然而,在一般情况下,靶向药物的耐药机制过于复杂,单假设检验研究要解决的问题很多,需要新的方法。此外,有数百个靶向药物正在开发或在临床上进行评估,联合试验的数量远超过了参与该研究的患者的数量。因此,需要使用实验模型发现并确定癌症患者的最佳联合治疗方案。第二个挑战涉及在临床上实现靶向抗癌药物的联合。这方面存在的问题包括毒性,药代动力学的相互作用,和治疗的最佳时机和背景。
挑战一:确定最佳联合方案
无偏移的药物筛查
新的药物联合可以通过无偏倚、高通量、全系统方法进行鉴定。高通量筛选所有由美国食品和药物管理局许可的药物联合已经在细胞系中进行研究以发现意想不到的协同作用,如抗寄生虫药物pentamidine与抗精神病药氯丙嗪在体外具有协同抗有丝分裂活性。在某些情况下,根据已经报告的临床不良反应使用无偏倚的模型已被用于预测药物联合的耐受性,但仍有待观察。这种方案的局限性是缺乏临床可行性,例如,驱虫药是针对细胞外应用,即使在体外具有抗癌活性,也不可能应用于人体。可以代替化学药物筛选的是,系统化、全基因组、功能受损的筛选可以评估肿瘤细胞中靶基因的具体作用,从而迅速确定可以联合使用的新药。
合成致死和siRNA筛查
合成致死的概念起源果蝇模型系统的研究,联合靶向两个或两个以上的单独基因突变导致细胞死亡,并利用癌细胞和正常细胞之间的固有生物差异。基因组短RNA(shRNA)和小干扰RNA(siRNA)–介导合成致死的药物敏感筛查揭示了新的靶向原癌驱动基因的联合治疗,包括那些以前被认为是无法靶向的基因,如KRAS和myc。研究人员通过敲除7000种人类基因表达的一系列siRNA 筛选了携带的野生型或突变型KRAS的人非小细胞肺癌细胞系,并发现了DNA转录因子GATA2和原癌基因kras之间的新型合成致死作用。目前,直接靶向GATA2是不可能的,但联合基因表达分析和染色质占用分析显示在RAS突变的非小细胞肺癌中,GATA2控制广泛的信号通路,包括调节蛋白酶体的NF-κB通路与Rho/ROCK相关信号通路。联合使用临床化合物硼替佐米(一种蛋白酶抑制剂)和法舒地尔(ROCK抑制剂),几乎导致小鼠KRAS驱动肺肿瘤模型的全部缓解。蛋白酶体抑制剂目前已被许可用于临床,然而ROCK抑制剂在肿瘤中的作用尚未验证。然而,这种组合可能是合成致死的siRNA筛选寻找KRAS突变肿瘤联合治疗方法的典范,这一战略也可以扩大到其他的肿瘤分子亚型中。
使用RNA干扰识别潜在药物联合的另一策略是模拟药理抑制作用模型。野生型细胞系或RNAi筛选导致某一特定基因损失的细胞系通过是否暴露于一特定的药物,以寻找药物协同或致敏作用。例如,一项大型无偏倚药物联合研究旨在确定对BRAF抑制剂vemurafenib先天性或获得性耐药的BRAF、RAS突变的黑色素瘤有效的药物联合,该研究发现,BRAF、EGFR和Akt抑制的三药联合对于BRAF突变的黑色素瘤细胞具有明显活性,并在体外克服vemurafenib的耐药性。此外,结果显示,他汀类药物和pan-CDK抑制剂对NRAS突变的黑色素瘤细胞有效。
siRNA筛选也可以用来解读不同的肿瘤背景的耐药机制。例如,BRAF抑制剂用于BRAFV600E突变黑色素瘤有效,而对于BRAFV600E突变结肠直肠癌(大肠癌)无效。靶向激酶活性的siRNA筛选表明,敲除EGFR与vemurafenib联合治疗导致BRAFV600E突变的CRC细胞合成致死,这表明BRAF突变与EGFR抑制剂联合疗法可能在临床上有效。随后研究发现,Raf和EGFR联合在BRAF突变结直肠癌模型中改善了体内疗效,多个临床试验正在探索该假设联合方案的疗效(nct01719380,nct01791309,nct01750918)。
siRNA筛选是确定和验证新的靶向药物的有力工具,虽然还存在很大的缺陷。首先,siRNA抑制只实现部分目标蛋白质的“敲除”。CRISPR-Cas9基因编辑技术可以补充和验证靶点,也许能弥补这一不足。第二,沉默的基因表达导致蛋白质所有功能的损失,可能并不能准确地概括靶向蛋白质单一功能的影响,如激酶活性。
系统生物学
系统生物学方法涉及大量数据的分析,包括遗传学、转录组学、蛋白质组学或影响翻译后调节的因素。我们可以创建、细化并实施不同的计算机模型,如Bayesian、逻辑基础或质量行动模型以分析磷酸化蛋白质组学数据并提供一种可检验的假设药物联合以克服靶向抗癌药物的耐药性。一些系统生物学方法研究蛋白质在细胞内信号网络中的重要性,基于药物靶点对细胞内关联的不同影响探索传统抗癌组合之外的联合。一项研究探索在小鼠模型中完全清除NRAS突变的“理想”状态,并确定了MEK和CDK4抑制剂联合使用的效果近似于NRAS转录效果的清除,从而提出一个可行的假设,即联合这两种靶向抗癌药物以开发临床上有效的治疗方案。迄今为止,这些数据集都具有基于生物学的解释,未来的应用可能涉及采用人工智能。
将生物学研究的结果应用于临床治疗还存在巨大的挑战。这些研究的结果需要在临床前实验被验证,然后筛选出临床可行的组合用于根据生物标记物定义的患者亚群。如果可以发现和改进为临床可行的组合,系统生物学的研究可能构建开拓出整个新的药物联合体系。
人体组织和原发肿瘤细胞分析
展望未来,基础人体样本的能准确反映人类肿瘤复杂性的疾病模型对于新药和药物联合的开发至关重要。虽然已经存在许多构建的细胞系库,然而这些细胞的遗传表征和人体肿瘤样本存在巨大的差异。研究人员正试图建立患者来源的细胞培养模型,例如从EGFR或ALK抑制剂治疗进展的肺癌患者活检样品提取细胞,随后在药物基因组学平台上检测这些模型以便迅速发现多种有效的药物组合,如ALK和SRC抑制剂的组合。这些模型比构建的细胞模型更能反映人类耐药肿瘤细胞的生物复杂性,但联合治疗的结果仍需要随机临床试验以验证。
患者来源移植模型(PDXs)也正在成为调查肿瘤生物学和耐药机制的强大工具,因为它们更忠实地概括患者肿瘤细胞的分子多样性、细胞异质性和组织学特征。PDXs用于证明临床前药效一个经典例子是EGFR突变肺癌PDX模型连续给予EGFR抑制剂治疗出现的ERK1和ERK2信号的激活。联合抑制EGFR 和MEK不仅在这种小鼠模型中延缓了耐药的发生,而且在一些小鼠中达到了治愈效果。此外,那些对双药联合耐药的肿瘤细胞被证明出现下游mTOR的激活,提供了进一步联合治疗策略。目前存在的不足是PDX模型的构建、繁殖和药物测试需要长达6个月的时间。随着PDX技术的发展,效率的提高和成本的降低,该技术很可能将提高患者的疗效。
挑战二:药物联合的实施
一旦选定合理的联合设计,其早期临床开发是一个复杂的过程,需要注意的事项很多,许多因素影响临床试验中联合策略的执行,包括毒性,药代动力学(PK)和药效学相互作用,治疗的时机,耐药的形成以及识别强有力的生物标志物来预测疗效。临床验证药物联合的疗效主要面临三大挑战:首先,如何进行药物联合;第二,什么时候实施药物联合;第三,哪些人群适合给予药物联合。
如何实现药物联合
靶向药物联合面临的最大挑战是每种药物的治疗范围很窄以及毒性重叠。在某些情况下,联合使用时可以给予每种靶向药物原来单药使用的全剂量,例如,黑色素瘤中联合给予dabrafenib和trametinib以及vemurafenib和cobimetinib。除了预期的重叠毒性外,联合用药还会出现一些特有的毒性反应,如发烧。
目前,我们无法根据临床前模型准确地预测毒性,这增加了优化药物联合的毒性效能平衡的挑战性。例如,联合抑制PI3K / AKT / mTOR途径和原癌基因RAS / RAF / MEK / ERK信号具有一定的前景,由于抑制一种途径会激活旁路信号从而引起耐药,然而由于重叠的毒性,给予足量的MEK和PI3K抑制剂联合已被证明在临床中原因非常困难。限制剂量所产生的毒性包括PI3K抑制剂相关的高血糖症、恶心、疲劳、皮疹和MEK抑制有关的胃肠道毒性、皮疹、腹泻和皮炎,阻碍了早期临床试验中这些药物的联合应用。然而,迄今为止已有不少联合试验通过多种减少剂量步骤来确定可耐受的联合剂量(图2A)。
此外,持续暴露于两种PI3K和MEK抑制剂在临床上是不可行的,大部分患者都需要中断治疗和剂量调整以维持。值得注意的是,在特定的原癌驱动突变细胞系进行信号转导量化的临床前研究表明,最大程度抑制MEK和AKT通路没有造成比MEK或AKT 单药最大剂量更好的效果,这一发现表明,开发药物更为积极的生物学战略是开始使用A药物100%的最佳生物剂量(OBD),后逐步升级药物B的剂量(图2b),或同时每日使用这两种药物的OBDs,但按时间表间断给药以提高耐受性(图2C)。
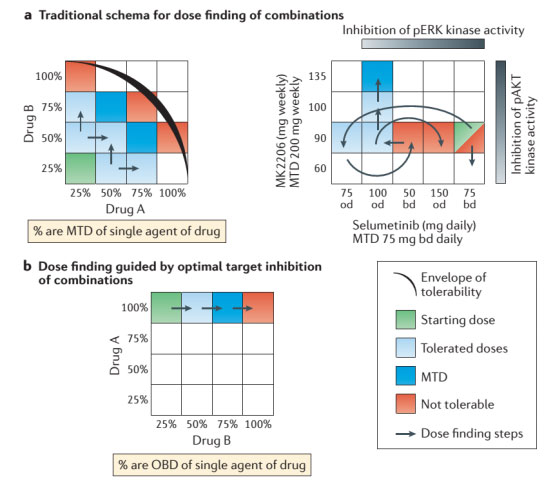
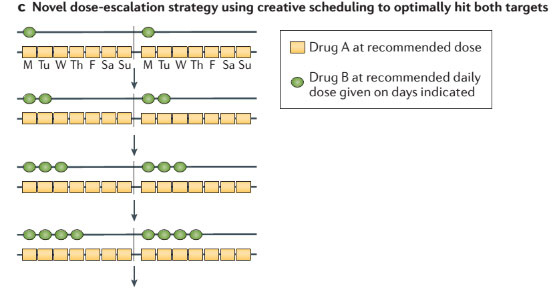
图2 药物联合的减量措施
另一影响如何结合靶向抗癌药物的问题是PK相互作用。例如,拉帕替尼是CYP450-3A4的酶作用物和中等抑制剂,并能大量减少了其他CYP450-3A4酶作用物等药物的清除。在拉帕替尼和pazopani的I期临床试验中,研究者比较两种药物的历史PK参数得出结论,药物联合并没有改变药物暴露量。然而,在第二阶段更详细的PK分析中,该联合在胶质瘤患者指示重要的药物 - 药物相互作用促成拉帕替尼的疗效降低。此外,该患者人群频繁使用抗癫痫药也减少了帕唑帕尼暴露,导致患者预后较差。这突出了详细的PK评估对于靶向抗癌药物联合评价的重要性。
联合用药的时机
评价药物联合治疗方案剂量和策略的初步研究往往在晚期疾病中进行。然而,定义用于评估药物联合在后期临床试验疗效的时机很关键。评估联合用药的时机应该根据假设联合的目的进行指导(图3)。

图3 未来克服耐药的临床设计模式
第一个问题是,该联合的目的是否是推迟耐药的发生,而不是增加肿瘤的杀伤力。例如,临床前研究结果支持联合HSP90抑制剂和激素治疗或者BRAF抑制剂以防止耐药的出现。理由是,HSP90缓冲了继发性突变给癌症细胞造成的代谢和环境压力的不利影响,这会导致获得性耐药的形成。抑制HSP90可以防止耐药的形成,因此,该组合应该用于转移性疾病的前期辅助或一线治疗。然而,目前药物的发展模式首先评估药物治疗晚期转移性疾病,因此联合治疗辅助和一线给药具有挑战性。
其次,该联合被检测是否是由于药物之一引起的一定程度的耐药可以被第二种药物逆转?同样的,这种情况下联合最好用于一线或新辅助治疗,例如帕妥珠单抗加入HER2阳性乳腺癌的曲妥珠单抗和化疗方案。一旦患者对化疗或曲妥珠单抗产生耐药性,这种组合不可能取得成功,因为帕妥珠单抗不可能扭转获得性抗性的多种机制。另一例子MEK抑制剂单一给药疗效不佳,由于激活代偿信号转导途径,如PI3K / AKT / mTOR信号。由于这联合假设涉及逆转原发性耐药,因此联合最好和MEK抑制剂一同使用,而不是已经形成耐药的情况下。这两个例子联合用药主要是增加缓解力度,但结果却提高无进展生存期,而不仅仅是抑制耐药的形成。
最后,联合用药的目的是否是逆转获得性耐药?肿瘤细胞发生二次突变、基因扩增和后期信号通路的激活是获得性耐药的共同特征。此时添加第二种药物应考虑克隆发展的动态性质,并且假设该肿瘤还存在对第一种药物敏感的克隆细胞,那么给予第二种药物应靶向对第一种药物产生耐药性的克隆。例如,HER2阳性晚期乳腺癌患者中联合应用HER2靶向药物以及mTOR抑制剂,这类患者的耐药性机制为PIK3CA二次突变或PI3K过表达。在未来,新的临床试验设计应包括在第一种药物耐药发生时加入第二种药物。更重要的,第二种药物加入时,第一种药物敏感的克隆应保留在肿瘤内,循环肿瘤DNA分析使得这种方法更为便利。类似的分子研究可以用于监测来在耐药发生前开始联合治疗。
适用联合治疗的人群
用于筛选可能对靶向治疗有效人群的阳性生物标记物包括突变基因(BRAF,EGFR),扩增基因(HER2)或易位基因(ALK),或蛋白质水平的改变(ER)。此外,一些阴性生物标志物也能筛选靶向治疗人群,例如KRAS突变以预测西妥昔单抗在CRC患者中的耐药性。然而,这样的标记可能并不能指导药物联合。例如,尽管BRAF和PIK3CA突变现已分别作为MEK和AKT 抑制剂生物标志物,有证据表明,KRAS突变是PI3K / AKT 联合应用的有效生物标志物。此外,MEK和AKT抑制剂联合治疗方案的经验还揭示了肿瘤背景对于治疗的重要性,该联合在KRAS突变的非小细胞肺癌和卵巢癌表明初步抗肿瘤活性,而对结肠癌无效。这表明我们需要在一个不断发展的复杂信号网络中理解和发现有效的生物标志物。
药物联合研究越来越多地使用基因构建小鼠模型和PDX模型反映人类肿瘤突变状态可能有助于更快速确定潜在的生物标志物。例如,同时敲除MEK和mTORC1 / 2在携带KRAS / BRAF和PIK3CA / PTEN102基因突变的大肠癌PDX模型中具有协同抗增殖作用,然而这只在p53野生型模型中被观察到,这表明p53基因野生型患者中,KRAS和PI3K突变可能具有预测联合治疗疗效的作用,该假设容易在早期的研究中进行验证。
免疫系统和微环境
另一个备受关注的潜在战略是联合抗肿瘤免疫治疗与分子靶向治疗。有人认为靶向治疗引起的肿瘤细胞死亡可能会触发抗原的释放和免疫调节,并激活免疫反应并根除肿瘤细胞。在此我们讨论免疫治疗联合分子靶向治疗的一些相关问题。
肿瘤免疫逃避的机制研究集中于相对早期阶段。虽然PD-1和CTLA-4同时表达衰减T细胞活化,我们需明确逃避免疫和适应性免疫耐受的特征。如果有足够被适应性免疫耐药机制抑制的T细胞存在于肿瘤当中,那么PD-1和PD-L1联合可能有效。如果T细胞没有渗入肿瘤,或者无法识别肿瘤抗原,那么联合策略将需要激活免疫反应或调控引起免疫耐受的肿瘤细胞和肿瘤微环境之间的相互作用。
研究已发现致癌信号传导途径与肿瘤免疫调节之间的相互作用,这表示免疫联合靶向治疗可能是一种有效的肿瘤治疗方法。例如,黑素瘤临床前模型表明肿瘤细胞中PTEN丢失增加了免疫抑制细胞因子表达,导致T细胞浸润肿瘤细胞水平降低。PI3K抑制剂治疗联合免疫检查点抑制剂改善了该模型中的疗效,且该假设能在临床试验进行验证。其他靶向治疗耐药小鼠模型,如伊马替尼表明耐药取决于免疫系统的间接影响,并发现伊马替尼与免疫抑制剂具有协同性。这种可能性目前正在早期试验(NCT01738139)中进行验证。
使用患者诊断收获样本研究耐药机制的PDX模型已经建立,虽然使用这些模型研究免疫耐受机制可能会受到小鼠自体免疫系统的影响。因此,这种情况下需要构建具有改良免疫系统的复杂的小鼠PDXs模型进行研究。
尽管有人担心联合免疫检查点抑制剂和靶向药物会带来严重的毒副反应,然而BRAF抑制剂vemurafenib联合抗PD-1或抗CTLA-4抗体研究显示毒性是可耐受的,尽管意外不良事件的发生率很高,如肝毒性,皮肤和神经毒性等。这个情况可能是由于BRAF抑制剂激活T细胞需要通过ERK信号,表明免疫治疗联合靶向治疗需要进行认真评估。
有研究正试图通过生物标志物识别可能对免疫治疗有效的患者。回顾性分析表明,联合抗CTLA-4和抗PD-1治疗的最大获益人群是肿瘤PD-L1阴性的患者,如果这一点未来在临床试验中被确认,表明生物标志物是选择免疫检查点调控因子联合治疗的关键。
结论
抗肿瘤的策略正在不断发展当中,靶向治疗药物经历了最初的兴奋之后遇到了较大的阻力,包括原发性耐药和获得性耐药。通过联合用药以解决耐药的策略已经取得一些进展,虽然面临相当大的挑战,联合用药的全部潜力尚未完全实现。
联合用药的前景较为乐观,新的技术,如能够识别合成致死药物联合的广泛使用的基因沉默工具,包括shRNA和CRISPR以及能够了解和预测复杂补偿性信号机制的磷酸化蛋白质组学技术,将有助于研究人员提出并预测有效的用药联合,包括本来不会考虑的联合或使用传统的、小规模、假设检验实验发现要慢得多的一些联合。此外,肿瘤细胞和患者血液中基因组学、转录组学和表观遗传学的序列检测将有助于肿瘤专家决定何时应用药物联合。最后,反映药物毒性和利用间歇剂量的临床试验设计和耐药出现后给予动态联合应用的适应性试验设计,将极大地加快更有效治疗联合的发展,以改善患者的疗效。
原文链接:Combine and conquer: challenges for targeted therapy combinations in early phase trials doi:10.1038/nrclinonc.2016.96 Published online 5 Jul 2016





 京公网安备 11010502033352号
京公网安备 11010502033352号