K16:PRRT新辅助治疗在可切除性/临界可切除性胰腺神经内分泌肿瘤(pNET)中的价值
这项回顾性、单中心观察性研究,旨在评估术前PRRT治疗在pNET中的价值。纳入25例可切除性/临界可切除性pNET患者,且患者至少具有以下特征之一:1)原发病灶直径大于4cm; 2)邻近脏器浸润,肠系膜上静脉/门静脉(SMV/PV)受累; 3)局部淋巴结受累; 4)存在可切除或存在切除可能的肝脏转移病灶。所有患者接受了术前PRRT治疗后进行根治性手术或减瘤手术。研究中18例患者的基因组数据可供使用分析。总生存期(OS)和无事件生存(EFS)通过Kaplan- Meyer方法进行评估。
研究结果显示,患者中位年龄51岁(范围24-72),其中13例为男性(52%)。原发肿瘤的常见部位胰体和胰尾(17例,68%)。初诊断时,14例是局部疾病(44%),11例存在远处转移(73%仅为肝脏转移)。9例为G1级(36%),15例为G2级(60%)和1例为G3级(4%)。患者接受中位5个周期的PRRT治疗(范围3-7),ORR为46%。接受PRRT治疗后,19例行根治性手术(76%),6例行减瘤手术(24%),其中18例患者(75%)达到R0切除。手术并发症与文献报道数据相似。中位随访时间为33.4个月,总人群中位EFS为46.9个月,中位OS为49.5个月。在根治性切除患者亚组中,未达到中位EFS和中位OS。
该研究提示,PRRT是一种有效安全的术前治疗方法,客观缓解率高,尤其是具有术后复发高危因素的G1/G2可切除性/临界可切除性pNET中,具有更高的价值。
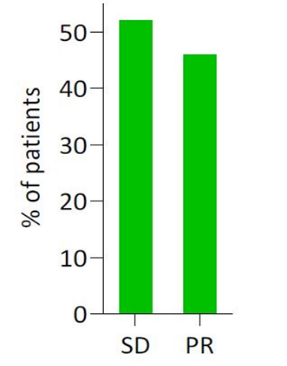
图1:PRRT新辅助治疗的客观缓解率:根据RECIST 1.1标准评估,部分缓解(PR)和疾病稳定(SD)
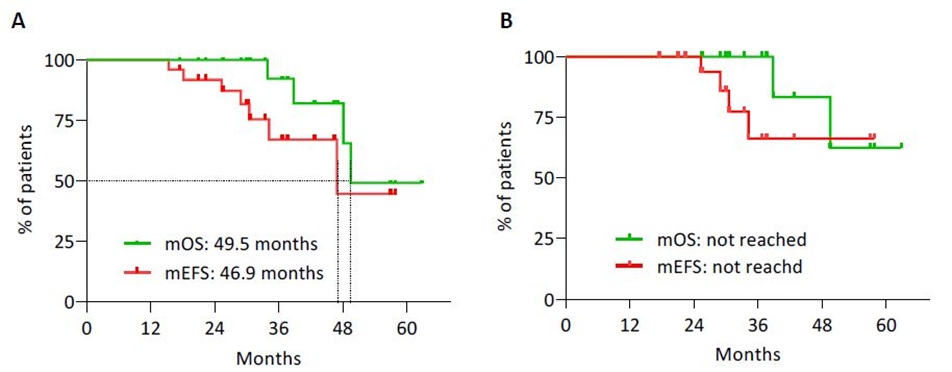
图2:(A)总体人群和(B)接受根治性手术患者的EFS和OS的Kaplan-Meier曲线
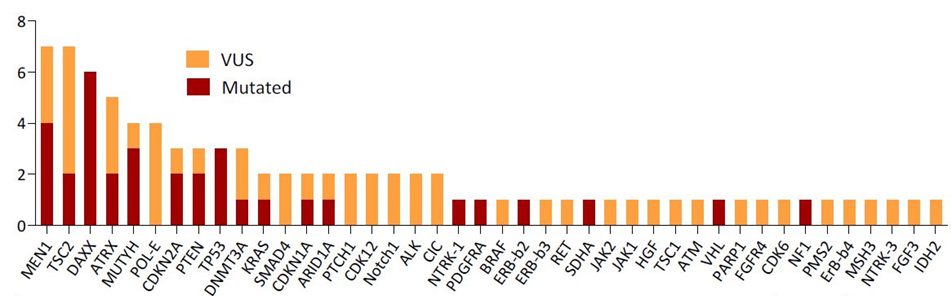
图3 突变基因和VUS(不确定重要性突变基因)的频率顺序18例患者结果分析显示最常见的突变基因为DAXX、MEN1、TP53、MUTYH、ATRX、CDKN2A、PTEN和TSC2;16例患者可评估微卫星状态(均稳定)和TMB(15低,中位1 Mut/Mb)
K21:PRRT联合CAPTEM,治疗胰腺和中肠神经内分泌肿瘤的疗效
为探讨PRRT联合CAPTEM治疗在晚期、进展性、不可切除神经内分泌肿瘤的疗效,纳入了组织病理学证实的pNET患者(n=14)和中肠NET患者 (n=7),进行前瞻性、单臂、开放标签研究。所有患者均接受了PRRT(177Lu-DOTATOC)和CAPTEM联合治疗,评估疾病状态和治疗效果,包括体能状态(PS-ECOG),根据RECIST 1.0标准评估客观缓解率(ORR),并与RECIST 1.1评估最佳客观缓解率(BORR)进行比较,疾病控制率计算为CR + PR + SD。差异组间评价采用Mann-U检验和Wilcoxon匹配检验,P<0.05为差异有显著性。
研究结果显示,随访期间所有受试者(n=21)中12例患者出现临床缓解,4例达到SD,1例在不可切除肿瘤初始PR后达到CR,且切除后随访6个月无肿瘤复发。其余3例受试者发生疾病进展(PD)。治疗前报告为PS0/1/2的初始PS ECOG如下:0/17/4,治疗后为:12/7/2,P<0.05。临床疗效见表1。随访期间BORR,14例达到PR(67%),其余受试者达到SD (33%)。16例(76%)患者随访期间可评估DCR,12例(86%)pNET患者达到PR。靶病灶缩小的最佳缓解(BORR)范围为32%-88%,其他2例为SD。在PR患者中,其中4例接受了原发性肿瘤切除手术。随访期间,4例患者出现PD,其余为PR或SD,16例(71%)患者可评估DCR。结果见表2,图1和图2中每个时间范围内,每例患者的瀑布图,为最初不可切除的全肝肿瘤患者的ORR,最终该肿瘤已被切除。中肠患者仅2例受试者达到PR (29%),其余为SD。随访期间,2例发生PD,1例发生临床疾病进展。临床上其中6例(86%)在随访期间缓解。
研究结果发现:基于PS分析,PRRT联合CAPTEM治疗,是临床治疗神经内分泌肿瘤的有效方法。该治疗在pNET患者ORR方面具有显著获益,在pNET的 PR患者中,其中4例切除了原发性肿瘤。在随访期间的DCR方面,pNET和中肠NET均有较高的缓解率。
表1 不同时间点联合治疗的临床疗效评估
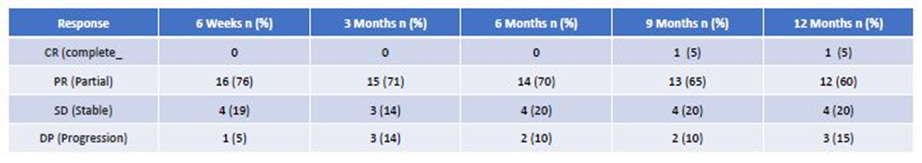
表2 不同时间点基于RECIST 1.0标准联合治疗的影像学疗效评估
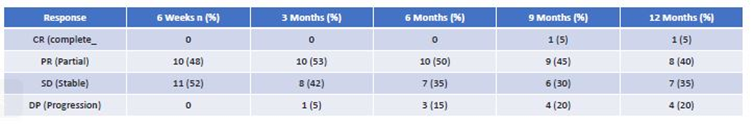
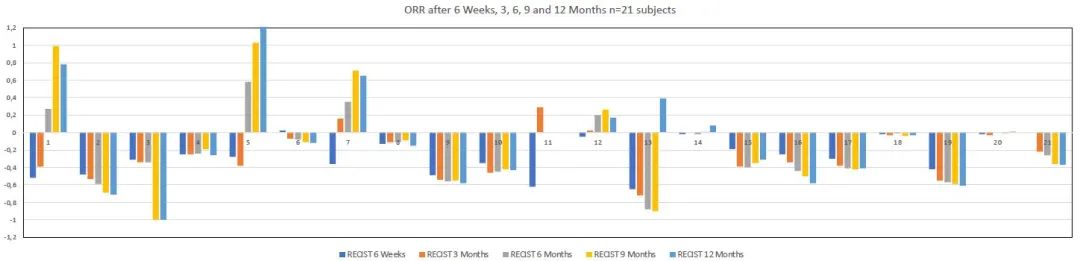
图1联合PRRT + CAPTEM治疗后6周、3个月、6个月、9个月和12个月不同时间点的ORR
K30:PRRT联合CAPTEM,治疗胰腺和中肠神经内分泌肿瘤的患者生活质量(QoL)
QoL是临床试验中的重要结果,尤其是在涉及慢性疾病的患者研究中,被越来越多的作为研究终点,本研究基于EORTC C-30和GINET-21问卷,评价PRRT联合CAPTEM在治疗期间和治疗后的QoL。本研究评估主观QoL,而不取决于肿瘤治疗阶段、治疗类型,或患者疾病晚期健康状况的显著恶化。这项在组织病理学证实的NET患者中,进行的前瞻性、单臂、开放标签研究,纳入pNET(n=14),中肠NET( n=7)。治疗期进行标准QLQ-C30核心和GINET-21问卷评估,然后每3个月随访一次。通过重复测量ANOVA和t-student检验评估潜在差异。
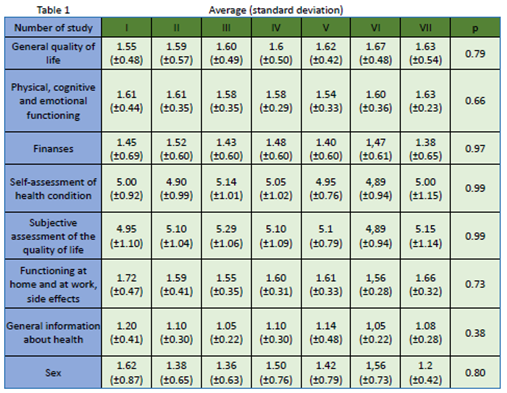
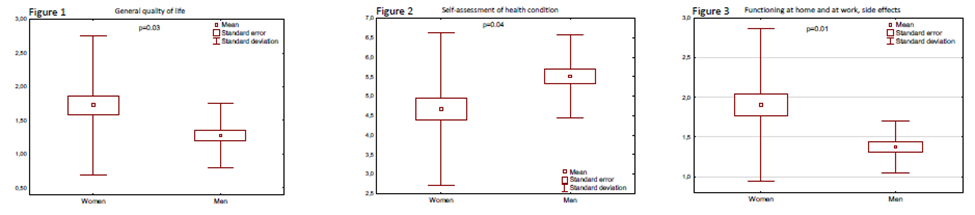
研究结果显示:21名患者,年龄40 - 78岁(59.3 ±11.5岁),13例患者(62%)为女性,8例患者(38%)为男性。如表1所示,尽管调查对象在随访期间QoL存在差异,但在统计学上差异不显著p>0.05。性别之间的统计关系:一般生活质量:女性-1.72 (± 0.51),男性1.28 (± 0.24),p=0.03。自我评估的健康状况因素,女性-4.67 (± 0.98),男性-5.50 (± 0.53) ,p=0.04。在家和工作时的功能状态女性-1.90(± 0.48), 男性-1.38 (± 0.16), p=0.01,见图1、2、3。结论表明,在随访期,即平均8 - 9个月治疗和接下来的9个月观察期,在一般生活质量、自我评估健康状态、在家和工作时的功能状态,不同性别间有显著性差异。已开展的研究未发现新的安全性信号或生活质量恶化。
K37:PRRT联合CAPTEM,治疗胰腺和中肠神经内分泌肿瘤的安全性
PRRT联合化疗(CAPTEM)是一种在进展性、晚期、不可切除GEP-NET中相对创新的治疗方法。组织病理学证实的pNET(n = 14)和中肠NET (n = 7)患者中进行的前瞻性、单臂、开放标签、2期研究,旨在评估PRRT联合CAPTEM治疗,在治疗期间和治疗后的安全性。表1为患者基线特征。患者以8 - 12周间隔接受3 - 4个周期的177Lu-DOTATOC联合CAPTEM(图1),在整个治疗期间和治疗后临床随访期间(至少12个月),评估了与联合治疗相关的不良事件(AE)和安全性。使用NCI-CTCAE第5.0版对AE进行分级。
研究结果为:1)治疗相关的AE主要是一过性血液学抑制。在治疗期间最常见的AE为淋巴细胞减少, 2级的淋巴细胞减少占44%,3级的占8%。血小板减少发生率为总患者的7%;2)1位患者由于AE提前中止治疗,其余3例患者由于初始PS=2而治疗期间没有改善提前中止治疗。研究总结,大多数患者可耐受该联合治疗,仅有少部分3级和4级AE出现,主要是治疗期间出现一过性淋巴细胞减少,常在PRRT治疗后第一周出现。
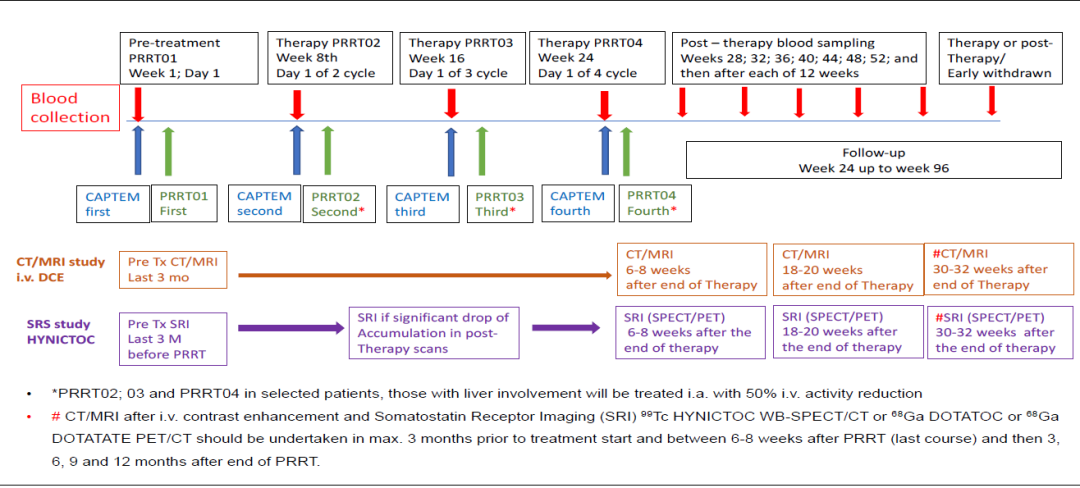
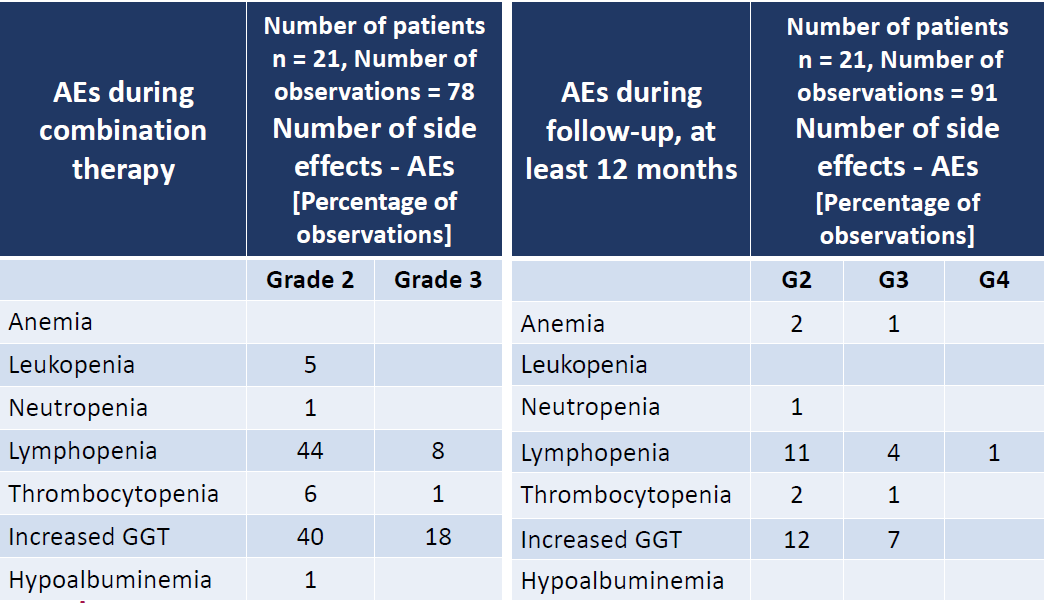
F09:PRRT联合CAPTEM治疗胰腺和中肠神经内分泌肿瘤的患者中,血清CgA和NSE对预测肿瘤治疗反应的价值
本研究在进展性、晚期、不可切除的NET中,基于联合治疗的ORR和其他临床反应,评估CgA和NSE作为肿瘤治疗反应预测因子的价值。在这项前瞻性、单臂、开放标签的研究中,纳入组织病理学证实的pNET(n=14)和中肠NET(n=7)患者,接受PRRT联合CAPTEM治疗,使用RECIST1.0标准评估ORR。血清CgA和NSE水平在治疗前后及随访期间均检测,并以平均/中位ULN的比例计算。此外,在每个受试者每次治疗前评估CgA值。各组间差异使用Mann-U test和Wilcoxon Matched test统计。
研究结果显示, 12例患者PR,1例CR,4例SD,4例PD。所有临床PR患者中,中位CgA从初始ULN 1.7下降到治疗6周时的1.0,治疗3个月时的0.9,治疗6个月时的1.3,治疗9个月时的1.2(Wilcoxon P<0.05)。但PR患者的CgA水平下降只见于pNET患者,而未见于中肠NET。在随访中出现临床或RECIST 疾病进展的患者,pNET患者CgA在最初下降后反而显著上升,但在中肠NET中无明显变化。并且对pNET患者分析显示,PD的患者中NSE明显高于初始时。
本研究提示,我们从临床反应和ORR观察到,PRRT联合CAPTEM治疗是一种有效的治疗方法。CgA和NSE均可作为pNET组对联合治疗反应的预测指标,但在中肠NET组则不适用。在临床或随访评估中联合治疗无效的pNET患者,CgA和NSE较初始值增加。
P01:PARP抑制剂联合177Lu-DOTATATE,治疗转移性神经内分泌瘤患者的1期试验-PARLuNET
177Lu-DOTATATE是治疗G1/G2级神经内分泌肿瘤患者的有效药物,而更多的治疗策略可优化PRRT治疗疗效。临床前数据显示,与177Lu -DOTATATE单药治疗相比, PARP抑制剂(PARPi)联合PRRT可显著促进NET细胞死亡和动物存活率。因此,该研究的联合治疗策略旨在提高PRRT的疗效,主要目的为确定talazoparib(PARPi)+ 177Lu -DOTATATE治疗进展性NET患者的最大耐受剂量(MTD)和剂量限制性毒性(DLTs)。次要目的为评估安全性,RECIST 1.1评估标准,以及PFS和OS。使用γ-H2AX评估循环淋巴细胞中的DNA损伤和修复。
本研究即将在Peter MacCallum Centre中心(ENETS卓越中心)开始,主要纳入标准:≥18岁;一线治疗(包括SSA)进展或无法控制激素分泌症状的胰腺起源的G2级(Ki-67 3-20%)NET;肿瘤摄取68Ga-DOTATATE PET/CT改良Krenning评分≥3;无不一致FDG-avid疾病;Hb≥100 g/L,中性粒细胞绝对计数≥1.5 ×109/L,血小板≥150×109/L,eGFR≥60 mL/min,白蛋白≥30 g/L;既往无PRRT或PARPi治疗。患者首先接受1个周期的177Lu -DOTATATE单药治疗,以确保患者没有本身存在的对PRRT的骨髓敏感性及倾向性。如果未出现DLT,则随后接受3个周期的177Lu -DOTATATE联合5天talazoparib治疗。每个周期为8周。考虑到固定剂量177Lu -DOTATATE和4个剂量水平的talazoparib(0.1,0.25,0.5或1.0mg),研究将使用贝叶斯最优区间(BOIN)设计确定本剂量递增研究中的MTD。最大样本量为24例患者进入了第2周期的治疗。随访时间为从第1周期开始至18个月。该研究预计在2021年上半年开始入组。
该I期研究即将评价在进展期G2级pNET患者中, PARPi联合 PRRT这种新型治疗组合的疗效和安全性,其结果将指导比较单用PRRT与PRRT+PARPi的随机Ⅱ期试验的设计。
K02:短间隔、低剂量(SILD)177Lu- DOTAiTATE治疗,对PD-1抑制剂免疫治疗抵抗的转移性Merkel细胞癌和恶性黑色素瘤的疗效
PD-1抑制剂已被证实对Merkel细胞癌(MCC)或黑色素瘤已被证实有效。本研究目的是验证SILD 177Lu- DOTAiTATE治疗,对PD-1抑制剂免疫治疗抵抗的转移性Merkel细胞癌和恶性黑色素瘤的疗效。材料和方法:6例PD-1抑制剂治疗抵抗的复发转移性MCC(n = 3)或黑色素瘤(n = 3)患者(1例女性,5例男性),进行 SSTRPET/CT成像,经过肿瘤跨学科委员会共识,对病灶存在低至中度SSTR表达的患者给与PRRT治疗。采用较低剂量(平均3 GBq/周期)和间隔较短(3 - 6周),以重塑肿瘤微环境,恢复对PD-1抑制剂帕博丽珠单抗的反应性。研究结果:4/6例患者(2例MCC,2例黑色素瘤)靶病灶表现为SSTR低至中度表达,3/6例患者接受了PRRT治疗。2例患者(MCC)接受了3个周期治疗, 1例患者(黑色素瘤)接受了1个周期的治疗。所有患者对PRRT治疗耐受良好。SSTR PET/CT发现2例MCC患者部分缓解,1例黑色素瘤患者对治疗的反应仍在等待中。结论:SILD PRRT(PRRT的Ulm)可用于恢复复发性或原发性难治性MCC患者对PD-1 抑制剂的反应性,其潜在机制需要在未来的临床试验中进一步探讨。PRRT的Ulm概念,可能为各种不同瘤种免疫治疗抵抗开辟新的治疗途径。





 京公网安备 11010502033352号
京公网安备 11010502033352号